「紅麹サプリ問題」受け、機能性表示食品検討会が“出入口厳格化”の報告書案公開…暫定案の先に新法設立はある?

小林製薬の紅麹サプリメントによる健康被害の拡大を受け、緊急開催された機能性表示食品を巡る、消費者庁の有識者検討会は最終となる6回目の会合(23日)を終え、報告書案をとりまとめた。提言には被害報告の義務化や品質管理の厳格化などが盛り込まれた。
”紅麹問題”を受け、4月19日から開催された検討会では、限られた時間の中で、主なテーマを3つに絞り、議論が進められた。
(1)健康被害情報の収集、行政機関への情報提供の義務等
(2)製造管理及び品質管理等
(3)消費者等への情報伝達の在り方
特に(1)(2)については、健康被害拡大につながる重要な要素と考えられ、分厚い議論が展開された。
健康被害報告、GMPにもとづく製造・品質管理義務化を
今回の小林製薬の事案では、健康被害の情報が消費者庁および都道府県知事へ報告されるまでに約2か月を要した。その結果、被害拡大につながった側面は否定できず、速やかな報告の義務化が求められた。
具体的には、医師の診断を受け、当該症状が当該食品に起因する、もしくはその疑いを否定できないとされた健康被害情報のすべてを、速やかに行政機関に提供することなどとした。提供期限も明確に規定し、法的義務とすることも盛り込まれた。
また、製造プロセスにおけるずさんな管理が露呈したことも重要視し、サプリメント形状の機能性表示食品の製造工程管理における品質確保の徹底も求められた。その実践のため、サプリメント形状の機能性表示食品に、届出者による準備期間を設けた上で法令で規定されたGMP(適正製造規範) にもとづく製造および品質管理を、届出時や届出後の販売期間中における法的義務とすることも提言された。
ひとまず「起こさない」「被害を拡大させない」に力点
検討会開催前には、消費者庁が厳しい姿勢で臨むことを伝えていたこともあり、機能性表示食品制度の刷新も予想された。だが、今回はあくまでも製品の”入り口”と”出口”を厳格化することで、「起こさない」「被害を拡大させない」にひとまず力点が置かれた形だ。
今回の提言は、既存の届出事業者も例外とせず、新ルール下で引き続き届出を維持できる方向で検討されている。
”暫定期間”経て新法へ発展の可能性も
もっとも、仮に機能性表示食品だけを厳格な管理にしても、「いわゆる健康食品に流れるだけ」という声も多く、それでは問題の抜本解決にはつながらない。そこで、将来的にはサプリメント法のような健康食品全体に関わる法規制を含む新法設立に発展する可能性はある。
機能性表示食品は、事業者の責任において科学的根拠にもとづく安全性や機能性などを消費者庁に届け出る仕組みで、品質管理や健康被害が起きた際の対応はガイドラインに定められている。同様に健康効果が表示できる「特定保健用食品(トクホ)」は、その効果や安全性について国が審査を行い、食品ごとに消費者庁が許可している。
効能効果をうたえる責任をどう仕組みに落とし込むのか…
医薬品でないいわゆる健康食品は、当初は「体にいい」というイメージだけで販売するしかなかった。1991年に誕生したトクホ制度は、そうした壁を打ち破り、健康効果の表示が可能となり、大きな市場を形成した。ところが、申請に臨床試験が求められるなど、許可を得るまでに莫大(ばくだい)な費用や時間を要することから大手メーカーでなければ対応しづらい状況にあった。
そうした中で、安倍政権下で規制緩和が実現し、 2015年に「機能性表示食品」というカテゴリーが生まれた経緯がある。
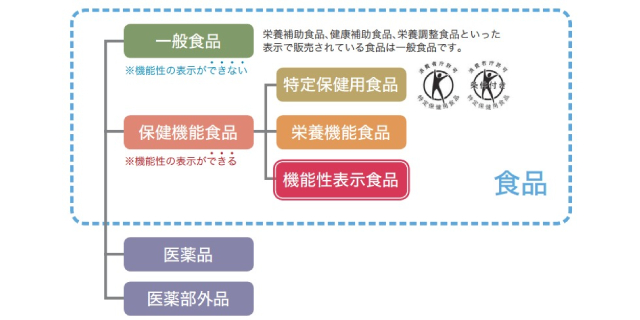
事業者にとって長年の悲願のカテゴリーであり、市場も2020年にトクホを上回って以降、拡大が続いている。一方で、消費者はトクホとの違いも含め、十分にその経緯や内容を理解しないまま、パッケージの機能性表示を頼りに商品選択をしてきた。
それだけに今回の”暫定案”をその場しのぎで終わらせず、中長期で先を見据え、じっくりと慎重に、消費者にとっての最善を意識しながら、新法創設も見据えた最終形へ深化させることが強く求められる。
- この記事は、公開日時点の情報や法律に基づいて執筆しております。
関連ニュース
-
「そのお土産、放棄してください」 国内でも売っているのに…“海外から持ち帰るとヤバい”植物とは?
2024年05月05日 08:48
-
「グルメフェス」の“衛生対策”はどうなっている? 「食中毒騒動」乗り越え11周年を迎えたイベントの“教訓”とは
2024年04月29日 09:29
-
紅麴サプリメント問題受け、制度改善へ初会合…機能性表示食品に「重みづけを」の意見も
2024年04月22日 11:04